- ANHYDRIDES D’ACIDES CARBOXYLIQUES
- ANHYDRIDES D’ACIDES CARBOXYLIQUESComme leur nom l’indique, les anhydrides d’acides dérivent des acides carboxyliques par perte d’eau. Leur formule, R 漣CO 漣O 漣CO 漣R, correspond à la déshydratation d’un couple d’acides identiques; toutefois il existe des anhydrides mixtes résultant de la perte d’une molécule d’eau entre deux molécules d’acides carboxyliques différents R 漣CO 漣O 漣CO 漣R , ou même entre un acide carboxylique et un oxacide minéral, comme l’anhydride acétonitrique CH3 漣CO 漣O 漣2. En outre, la déshydratation intramoléculaire de certains acides conduit à un anhydride interne appelé cétène, comme le diphénylcétène (C6H5)2C 略C 略O dérivé de l’acide diphénylacétique (C6H5)2CH 漣COOH.Compte tenu de leur facile hydrolyse, les anhydrides n’existent pas à l’état naturel. Par contre, leur grande réactivité en fait des intermédiaires importants de la synthèse organique industrielle, notamment les anhydrides acétique et ortho-phtalique. Le premier est un agent d’acétylation très employé en chimie fine (pharmacie, pesticides, colorants), mais également en chimie plus lourde (fibres et films de triacétate de cellulose), le second intervient dans la fabrication de polyesters divers, bases de vernis, de plastifiants et de colorants.NomenclatureLe nom des anhydrides symétriques dérive de celui des acides correspondants en remplaçant le substantif acide par anhydride. Par exemple, anhydride acétique (CH3 漣CO)2O, anhydride propionique (C2H5 漣CO)2O.Les anhydrides mixtes sont désignés comme anhydrides d’acide A et d’acide B, par exemple, anhydride d’acide benzoïque et d’acide acétique C6H5 漣CO 漣O 漣CO 漣CH3, anhydride sulfoacétique CH3 漣CO 漣O 漣S3H.Préparations et modes de formationUne méthode générale de préparation, au laboratoire, des anhydrides symétriques consiste à déshydrater l’acide carboxylique correspondant. L’agent déshydratant le plus efficace est l’anhydride acétique, fabriqué industriellement par une autre voie; en présence d’une quantité catalytique d’acide sulfurique, le mélange de deux molécules d’acide et d’une molécule d’anhydride acétique est chauffé à 120 0C: l’échange fonctionnel se produit et l’équilibre est déplacé par distillation de l’acide acétique formé, qui est le constituant le plus volatil du mélange réactionnel.Une seconde méthode également générale fait réagir le chlorure de l’un des deux acides sur un sel alcalin de l’autre:
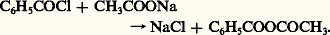 L’obtention d’un anhydride symétrique par cette méthode n’implique pas l’isolement du chlorure d’acide: on peut faire réagir, sur le carboxylate alcalin, un agent de chloruration comme l’oxychlorure de phosphore.La fabrication industrielle de l’anhydride acétique met en œuvre deux matières premières différentes: l’acétaldéhyde et l’acide acétique.– Préparation par oxydation de l’acétaldéhyde: ce composé est oxydé par l’air en présence d’un catalyseur constitué par un mélange d’acétates de cuivre et de cobalt.– Préparation par déshydratation de l’acide acétique: en présence d’un catalyseur comme le phosphate triéthylique, ce composé est porté un temps très court à 700 0C; il se produit une déshydratation de la molécule en cétène. Le processus étant réversible, le mélange réactionnel est brutalement refroidi à 漣 20 0C (trempe): l’eau se sépare et le cétène est immédiatement absorbé par de l’acide acétique anhydride à 50 0C. Le rendement de cette synthèse est excellent (réaction 1a).Le même procédé permet de préparer des anhydrides mixtes d’acide acétique et d’un autre acide par absorption, par ce dernier, du cétène formé au départ de l’acide acétique (réaction 1b).Les anhydrides de diacides sont habituellement obtenus par chauffage à 150-200 0C de ces derniers; l’anhydride maléique est un intermédiaire important de la chimie des résines polyester insaturées pour la fabrication de matériaux composites, de produits phytosanitaires, de plastifiants et d’additifs pour lubrifiants. Il est fabriqué par oxydation à l’air, sur catalyseur de pentoxyde de vanadium V25, soit du benzène, soit des butènes.L’anhydride succinique est lui-même obtenu par hydrogénation sélective de l’anhydride maléique par le nickel de Raney.Les cétènes, anhydrides internes d’acides carboxyliques, peuvent être préparés par déshydrohalogénation de chlorures d’acides par une amine tertiaire.Le cétène est obtenu industriellement par pyrolyse de l’acide acétique (réaction 1). Au laboratoire, mais également à l’échelle industrielle, on pyrolyse également l’acétone:
L’obtention d’un anhydride symétrique par cette méthode n’implique pas l’isolement du chlorure d’acide: on peut faire réagir, sur le carboxylate alcalin, un agent de chloruration comme l’oxychlorure de phosphore.La fabrication industrielle de l’anhydride acétique met en œuvre deux matières premières différentes: l’acétaldéhyde et l’acide acétique.– Préparation par oxydation de l’acétaldéhyde: ce composé est oxydé par l’air en présence d’un catalyseur constitué par un mélange d’acétates de cuivre et de cobalt.– Préparation par déshydratation de l’acide acétique: en présence d’un catalyseur comme le phosphate triéthylique, ce composé est porté un temps très court à 700 0C; il se produit une déshydratation de la molécule en cétène. Le processus étant réversible, le mélange réactionnel est brutalement refroidi à 漣 20 0C (trempe): l’eau se sépare et le cétène est immédiatement absorbé par de l’acide acétique anhydride à 50 0C. Le rendement de cette synthèse est excellent (réaction 1a).Le même procédé permet de préparer des anhydrides mixtes d’acide acétique et d’un autre acide par absorption, par ce dernier, du cétène formé au départ de l’acide acétique (réaction 1b).Les anhydrides de diacides sont habituellement obtenus par chauffage à 150-200 0C de ces derniers; l’anhydride maléique est un intermédiaire important de la chimie des résines polyester insaturées pour la fabrication de matériaux composites, de produits phytosanitaires, de plastifiants et d’additifs pour lubrifiants. Il est fabriqué par oxydation à l’air, sur catalyseur de pentoxyde de vanadium V25, soit du benzène, soit des butènes.L’anhydride succinique est lui-même obtenu par hydrogénation sélective de l’anhydride maléique par le nickel de Raney.Les cétènes, anhydrides internes d’acides carboxyliques, peuvent être préparés par déshydrohalogénation de chlorures d’acides par une amine tertiaire.Le cétène est obtenu industriellement par pyrolyse de l’acide acétique (réaction 1). Au laboratoire, mais également à l’échelle industrielle, on pyrolyse également l’acétone: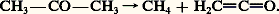 Propriétés physiquesL’anhydride formique n’a jamais été isolé. L’anydride mixte acétoformique, de formule CH3 漣CO 漣O 漣CO 漣H, résultant de l’action du chlorure d’acétyle sur le formiate d’argent, est instable et se décompose facilement en acide acétique et monoxyde de carbone. La plupart des anhydrides sont des liquides incolores, d’odeur piquante, dont les températures d’ébullition sont supérieures à celles des acides correspondants. Les anhydrides cycliques des diacides sont souvent cristallisés.Propriétés chimiquesComme les chlorures d’acides, les anhydrides sont sensibles à l’attaque par les réactifs nucléophiles; leur réactivité est toutefois plus faible.HydrolyseÀ froid et en l’absence de catalyseur, les anhydrides s’hydrolysent plus lentement que les chlorures d’acides, mais moins que les esters. À 100 0C, l’anhydride acétique est hydrolysé en quelques minutes.AlcoolyseLa réaction des anhydrides avec les alcools, à froid et en l’absence de catalyseur, est très lente. Il faut chauffer et employer un catalyseur acide ou basique pour que la vitesse d’alcoolyse soit fortement accélérée. Le catalyseur acide transforme l’anhydride en son acide conjugué et le groupe partant moyen CH3C-, en bon groupe partant neutre CH3COOH: les alcools primaires et secondaires sont rapidement estérifiés.Les meilleures conditions d’estérification des alcools tertiaires et des phénols mettent en œuvre le catalyseur basique pyridine. Cette dernière attaque l’anhydride en le transformant en acétate d’acétylpyridinium, qui est un acétyle fortement activé et dont l’alcoolyse est très rapide et spécifique.Les aldéhydes aliphatiques réagissent sur les anhydrides en formant des gem. diesters, décomposables en esters d’énols.Ammonolyse, aminolyseL’ammoniac et les amines primaires et secondaires réagissent sur les anhydrides en donnant des amides:
Propriétés physiquesL’anhydride formique n’a jamais été isolé. L’anydride mixte acétoformique, de formule CH3 漣CO 漣O 漣CO 漣H, résultant de l’action du chlorure d’acétyle sur le formiate d’argent, est instable et se décompose facilement en acide acétique et monoxyde de carbone. La plupart des anhydrides sont des liquides incolores, d’odeur piquante, dont les températures d’ébullition sont supérieures à celles des acides correspondants. Les anhydrides cycliques des diacides sont souvent cristallisés.Propriétés chimiquesComme les chlorures d’acides, les anhydrides sont sensibles à l’attaque par les réactifs nucléophiles; leur réactivité est toutefois plus faible.HydrolyseÀ froid et en l’absence de catalyseur, les anhydrides s’hydrolysent plus lentement que les chlorures d’acides, mais moins que les esters. À 100 0C, l’anhydride acétique est hydrolysé en quelques minutes.AlcoolyseLa réaction des anhydrides avec les alcools, à froid et en l’absence de catalyseur, est très lente. Il faut chauffer et employer un catalyseur acide ou basique pour que la vitesse d’alcoolyse soit fortement accélérée. Le catalyseur acide transforme l’anhydride en son acide conjugué et le groupe partant moyen CH3C-, en bon groupe partant neutre CH3COOH: les alcools primaires et secondaires sont rapidement estérifiés.Les meilleures conditions d’estérification des alcools tertiaires et des phénols mettent en œuvre le catalyseur basique pyridine. Cette dernière attaque l’anhydride en le transformant en acétate d’acétylpyridinium, qui est un acétyle fortement activé et dont l’alcoolyse est très rapide et spécifique.Les aldéhydes aliphatiques réagissent sur les anhydrides en formant des gem. diesters, décomposables en esters d’énols.Ammonolyse, aminolyseL’ammoniac et les amines primaires et secondaires réagissent sur les anhydrides en donnant des amides: Réaction avec les nucléophiles carbonésÀ 漣 60 0C, les organomagnésiens donnent des cétones qui, à cette température, ne réagissent pas sur l’organométallique.Les anhydrides, comme les chlorures d’acides, en présence d’un acide de Lewis (BF3, AlCl3) se condensent sur les cycles aromatiques en formant des arylcétones. Une intéressante application de cette réaction, mettant en œuvre un anhydride cyclique, permet de réaliser, en deux temps, des réactions de cyclisation. L’anhydride succinique permet ainsi d’ajouter un noyau supplémentaire à un dérivé aromatique.En catalyse acide, les cétones sont acétylées par l’anhydride acétique. L’énol le plus substitué de la cétone attaque l’anhydride activé par l’acide.OxydationL’eau oxygénée oxyde les anhydrides en peroxydes de diacyle. L’anhydride acétique, traité par le peroxyhydrate de métaborate de sodium, se transforme en peroxyde de diacétyle, un liquide incolore qui explose au chauffage. Dans des conditions voisines, l’anhydride benzoïque est transformé en peroxyde de dibenzoyle. Ces peroxydes d’acyle ou d’aroyle sont des initiateurs de réactions radicalaires. Leur décomposition thermique contrôlée correspond à la rupture homolytique de la liaison peroxydique avec formation de radicaux libres acyloxy- ou aroyloxy-. Ces derniers peuvent subir ultérieurement une fragmentation unimoléculaire, conduisant à des radicaux libres alkyle ou aryle, avec départ de C2:
Réaction avec les nucléophiles carbonésÀ 漣 60 0C, les organomagnésiens donnent des cétones qui, à cette température, ne réagissent pas sur l’organométallique.Les anhydrides, comme les chlorures d’acides, en présence d’un acide de Lewis (BF3, AlCl3) se condensent sur les cycles aromatiques en formant des arylcétones. Une intéressante application de cette réaction, mettant en œuvre un anhydride cyclique, permet de réaliser, en deux temps, des réactions de cyclisation. L’anhydride succinique permet ainsi d’ajouter un noyau supplémentaire à un dérivé aromatique.En catalyse acide, les cétones sont acétylées par l’anhydride acétique. L’énol le plus substitué de la cétone attaque l’anhydride activé par l’acide.OxydationL’eau oxygénée oxyde les anhydrides en peroxydes de diacyle. L’anhydride acétique, traité par le peroxyhydrate de métaborate de sodium, se transforme en peroxyde de diacétyle, un liquide incolore qui explose au chauffage. Dans des conditions voisines, l’anhydride benzoïque est transformé en peroxyde de dibenzoyle. Ces peroxydes d’acyle ou d’aroyle sont des initiateurs de réactions radicalaires. Leur décomposition thermique contrôlée correspond à la rupture homolytique de la liaison peroxydique avec formation de radicaux libres acyloxy- ou aroyloxy-. Ces derniers peuvent subir ultérieurement une fragmentation unimoléculaire, conduisant à des radicaux libres alkyle ou aryle, avec départ de C2: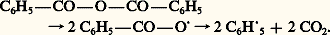 Traités par un alcoolate alcalin, ces peroxydes se transforment en peracides avec libération d’une molécule d’ester.Réduction des anhydrides cycliquesL’anhydride succinique, hydrogéné sur catalyseur au nickel-rhénium, est réduit successivement en 塚-butyrolactone et en tétrahydrofuranne; l’hydrogénation plus complète en butane-1,4-diol est réalisée sur catalyseur à base de Ni-Co-Th2/Si2, à 150 0C et 100 bars.Les anhydrides comme nucléophilesLes aldéhydes aromatiques additionnent l’anhydride acétique transformé en énolate par le catalyseur acétate de potassium. C’est la réaction de Perkin (1868). L’adduit, qui est un alcool benzylique 廓-anhydride, est particulièrement sensible à une élévation de température et se déshydrate en donnant un acide 見-éthylénique (acide cinnamique dans le cas du benzaldéhyde).Condensations de l’anhydride phtaliqueL’anhydride orthophtalique, obtenu industriellement par oxydation à l’air, en présence d’anhydride vanadique V25, du naphtalène ou de l’orthoxylène, est une matière intermédiaire importante pour la fabrication d’esters, de polyesters et de colorants. En catalyse acide, cet anhydride est activé vis-à-vis des réactifs nucléophiles comme les phénols, les métadiphénols et les métaalkylaminophénols qui se condensent en donnant respectivement des phtaléines, des fluorescéines et des rhodamines.Ces molécules, notamment les phtaléines, subissent, en milieu basique, une modification structurale qui est accompagnée d’un changement de couleur. La phénolphtaléine, incolore en milieu neutre ou acide, devient rose en milieu basique: elle est utilisée comme indicateur coloré dans les titrages acido-basiques.L’anhydride phtalique réagit, en présence de chlorure d’aluminium, avec le benzène pour donner l’acide orthobenzoylbenzoïque; chauffé en milieu acide sulfurique concentré, ce dernier se transforme en anthraquinone, dont c’est une procédé industriel de préparation.Propriétés des cétènesLes cétènes, anhydrides internes, sont des molécules très réactives. Ils se dimérisent réversiblement en formant une 廓-lactone: le cétène se condense à température ordinaire en 廓-méthylène propiolactone ou dicétène. Ce dernier est employé industriellement pour fabriquer l’acétylacétate d’éthyle, intermédiaire important de synthèse en chimie fine.Le cétène monomère est un gaz (Téb 漣 56 0C) très toxique, qui n’est stable qu’à très basse température (face=F0019 漣 80 0C). Il sert essentiellement comme agent d’acétylation de composés à hydrogène acide. Il additionne l’eau en donnant l’acide acétique, les alcools en donnant des esters acétiques, les amines en donnant des amides, les acides en donnant des anhydrides.
Traités par un alcoolate alcalin, ces peroxydes se transforment en peracides avec libération d’une molécule d’ester.Réduction des anhydrides cycliquesL’anhydride succinique, hydrogéné sur catalyseur au nickel-rhénium, est réduit successivement en 塚-butyrolactone et en tétrahydrofuranne; l’hydrogénation plus complète en butane-1,4-diol est réalisée sur catalyseur à base de Ni-Co-Th2/Si2, à 150 0C et 100 bars.Les anhydrides comme nucléophilesLes aldéhydes aromatiques additionnent l’anhydride acétique transformé en énolate par le catalyseur acétate de potassium. C’est la réaction de Perkin (1868). L’adduit, qui est un alcool benzylique 廓-anhydride, est particulièrement sensible à une élévation de température et se déshydrate en donnant un acide 見-éthylénique (acide cinnamique dans le cas du benzaldéhyde).Condensations de l’anhydride phtaliqueL’anhydride orthophtalique, obtenu industriellement par oxydation à l’air, en présence d’anhydride vanadique V25, du naphtalène ou de l’orthoxylène, est une matière intermédiaire importante pour la fabrication d’esters, de polyesters et de colorants. En catalyse acide, cet anhydride est activé vis-à-vis des réactifs nucléophiles comme les phénols, les métadiphénols et les métaalkylaminophénols qui se condensent en donnant respectivement des phtaléines, des fluorescéines et des rhodamines.Ces molécules, notamment les phtaléines, subissent, en milieu basique, une modification structurale qui est accompagnée d’un changement de couleur. La phénolphtaléine, incolore en milieu neutre ou acide, devient rose en milieu basique: elle est utilisée comme indicateur coloré dans les titrages acido-basiques.L’anhydride phtalique réagit, en présence de chlorure d’aluminium, avec le benzène pour donner l’acide orthobenzoylbenzoïque; chauffé en milieu acide sulfurique concentré, ce dernier se transforme en anthraquinone, dont c’est une procédé industriel de préparation.Propriétés des cétènesLes cétènes, anhydrides internes, sont des molécules très réactives. Ils se dimérisent réversiblement en formant une 廓-lactone: le cétène se condense à température ordinaire en 廓-méthylène propiolactone ou dicétène. Ce dernier est employé industriellement pour fabriquer l’acétylacétate d’éthyle, intermédiaire important de synthèse en chimie fine.Le cétène monomère est un gaz (Téb 漣 56 0C) très toxique, qui n’est stable qu’à très basse température (face=F0019 漣 80 0C). Il sert essentiellement comme agent d’acétylation de composés à hydrogène acide. Il additionne l’eau en donnant l’acide acétique, les alcools en donnant des esters acétiques, les amines en donnant des amides, les acides en donnant des anhydrides.
Encyclopédie Universelle. 2012.
